Projekte

A01
Für die Entwicklung neuartiger adjuvanter Therapien zur Verhinderung der Metastasenbildung ist es von entscheidender Bedeutung, die genetische, epigenetische und funktionelle Ausstattung von disseminierten Krebszellen (DCCs) zu verstehen. Im Projekt A01 werden wir dies in einem dreistufigen Ansatz angehen. Zunächst werden wir Zellstammbäume von longitudinal gesammelten Proben aus Pateinten erstellen, die vom M0-Stadium zum M1-Stadium der Krankheit fortschreiten. Wir werden die DCC(s) identifizieren, die der Wurzel des Metastasen-Zweiges des Zellstammbaums am nächsten liegen und genetisch charakterisieren. Zweitens werden wir die Transkriptome und Genome der DCCs untersuchen, um die molekularen Mechanismen der frühen metastatischen Kolonisierung verstehen zu lernen. Drittens werden wir zelluläre Modelle entwickeln, die repräsentativ für die Metastasengründer sind, um funktionelle Studien durchzuführen und Therapieziele zu identifizieren.
A02
Tumorprogression und metastatische Kolonisation sind dynamische Prozesse. Es gibt frühe wie späte Ereignisse. Einige Ereignisse ermöglichen erst die Metastasierung, während andere den kompletten Krankheitsverlauf steuern (Driver Mutations). Diese Events sind in öffentlich zugänglichen Tumoratlanten kartiert. In diesem Projekt komplementieren wir den Atlas mit einem Geschichtsbuch. Dabei bauen wir auf unserem MHN Algorithmus auf, und annotieren Mutationen und andere Progressionsereignisse mit dem typischen Zeitpunkt ihres Auftretens, mit einem Cancer Driver Score und mit möglichen Assoziationen mit Metastasierung. Um auch immunologische und klinische Ereignisse miteinzuschließen, arbeiten wir mit der laufenden Brustkrebsstudie PRAEGNANT zusammen. Hier werden 850 Paare von Primärtumoren und Metastasen sequenziert, und darüber hinaus werden die Tumore immunologisch charakterisiert und der klinische Verlauf dokumentiert.
A03
Die metastatische Kolonisierung erfordert eine dynamische Adaptation von Tumorzellen and sich permanent ändernde Bedingungen der Tumorumgebung. Dies wird durch die Aktivierung des embryonalen Programmes der epithelialen-mesenchymalen Transition (EMT) ermöglicht, welche Tumorzellen die notwendige Plastizität verleiht. Wir und andere Arbeitsgruppen haben gezeigt, dass diese Plastizität auch die permanente Adaptation metabolischer Prozesse einschließt. In Projekt A03 werden wir untersuchen, wie die EMT-Aktivierung mit metabolischen Veränderungen in der metastatischen Kolonisierung verknüpft ist, mit dem Ziel molekulare “Schwachstellen“ als neue therapeutische Angriffspunkte zu identifizieren. Wir werden charakterisieren, wie EMT-Faktoren metabolische Prozesse (z.B. den Wechsel in zentralen Energie-Signalwegen) regulieren, neue Wege eines gezielten Eingreifens erforschen und die Ergebnisse an humanen Krebserkrankungen validieren.
A04
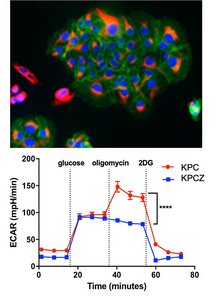
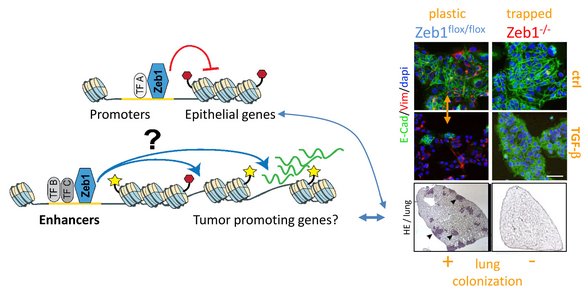
Phänotypische Plastizität befähigt Tumorzellen zur Metastasenbildung. Der EMT-Transkriptionsfaktor Zeb1 vermittelt diese Plastizität und forciert die Entstehung von Metastasen, die mit einer substantiellen Enhancer-Reprogrammierung einhergeht. Zeb1 knock-out Zelllinien aus einem genetischen Mausmodell des Pankreaskarzinoms (KPC) sind im epithelialen Phänotyp fixiert und bilden im Vergleich mit plastischen Zeb1 wt Linien, sehr wenige Lungenkolonien. Da Zeb1 als transkriptioneller Koaktivator in putativen Enhancer-Regionen fungiert, wollen wir hier die Enhancer-Landschaft der oben genannten Zelllinien untersuchen, um Zeb1-abhängige Enhancer, ihre Zielgene, und deren Relevanz für die Metastasenentstehung zu bestimmen. Die Ergebnisse werden in humanen Zelllinien und Organoiden validiert. So können wir die molekularen Zusammenhänge der Metastasierung besser verstehen und als Grundlage für neue prognostische und therapeutische Ansätze nutzen.
A05
Wir haben kürzlich herausgefunden, dass der Chromatin-Remodellierungsfaktor Baz2a in migrierenden Brustkrebszellen mit Stammzelleigenschaften stark hochreguliert ist. Darüber hinaus wird Baz2a in kleinen Mikrometastasen hochreguliert und in stark proliferativen, fortgeschrittenen Primärtumoren und Metastasen niederreguliert. Baz2a ist eine Untereinheit des Chromatin-Remodellierungskomplexes NoRC, welcher eine wichtige Rolle als epigenetischer Regulator in der Genexpression spielt. Baz2a bindet an eine nicht-kodierende RNA (pRNA), die die Funktion, sowie das genomische Targeting des Komplexes reguliert. Wir vermuten, dass die Baz2a-Expression und die Prozessierung der pRNA eine wichtige Rolle bei der Regulation der Plastizität von Krebszellen spielen, indem sie Genexpression und Phänotyp der Krebszellen verändern und die metastatische Kolonisierung ermöglichen. Wir wollen uns mit der molekularen Rolle von Baz2a-haltigen Remodellierungskomplexen im Prozess der Metastasierung befassen, mit seiner Rolle bei der Induktion von Stemness und Überleben von Brustkrebszellen nach ihrer Dissemination, sowie mit ihrem Einfluss auf die Kolonisierung im Zielorgan.
A06
Zur Ausbildung von Metastasen aus gestreuten Tumorzellen (disseminated cancer cells, DCCs) ist eine Adaptation an die neue, später metastasentragende Gewebeumgebung notwendig. Man geht davon aus, dass diese Adaptation adjuvante Chemotherapien erschwert oder behindert. Dennoch stellt die erfolgreiche Überwindung dieses Hemmnisses durch DCCs und letztlich die Metastasenbildung den Hauptgrund für Krebsbedingte Mortalität dar. Niedrigdosierte, metronome Chemotherapie (LDM) hat sich in manchen, gegenüber Standardtherapie refraktären Patienten, als erfolgreich erwiesen. In Vorarbeiten konnten wir zeigen, dass nichtkodierende RNAs eine wichtige Funktion in der Metastasierung unter LDM spielen. Auch konnten wir zeigen, dass einige lange, nichtkodierende RNAs für Mikropeptide kodieren, deren Funktion bislang unbekannt ist. Im Projekt A06 werden wir daher die Funktion dieser nichtkodierenden RNAs und der zugehörigen Mikropeptide, welche für eine Chemotherapieresistenz und letztlich Metastasenbildung verantwortlich sein könnten, entschlüsseln.
A07
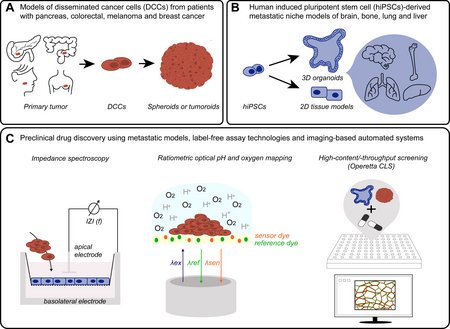
Ziel dieses Projektes ist die Entwicklung komplexer 3D in vitro Modelle und maßgeschneiderter Assays, um das Verständnis metastatischer Progression und die Erforschung neuer Wirkstoffe dagegen voranzutreiben. Die biologischen Modelle dienen der Nachahmung der Fundamentalprozesse der frühen Metastasierung für eine daran ausgerichtete Medikamentenentwicklung. Das Projekt hat drei Teilziele: (i) Entwicklung von 3D Tumor-Organoiden aus Patientenmaterial und deren Anpassung an die Randbedingungen eines Hochdurchsatz-Screenings. (ii) Entwicklung induzierter pluripotenter Stammzell-basierter, homo- und heterotypischer in vitro Modellen metastatischer Nischen, die für Brust-, Pankreas-, Dickdarmtumore sowie Melanome typisch sind. (iii) Weiterentwicklung und Kombination von mikroskopischer und label-freier, integraler Messtechnik zum Monitoring der Nischenmodelle unter Einfluss von Tumorzellen oder während einer therapeutischen Intervention. Die Kombination komplexer in vitro Modelle mit optimierten Assay-Formaten verspricht grundlegende und anwendungsnahe Erkenntnisse.
B01
Tumor-infiltrierende, myeloide Zellen greifen entscheidend in die Tumorprogression bis zur Metastasierung ein. Insbesondere Tumor-assoziierte Macrophagen (TAMs) können sowohl Metastasierung fördern als auch hemmen. Die zugrundeliegenden Mechanismen sind nur wenig verstanden. Wir konnten in Vorarbeiten zeigen, daß der Transkriptionsfaktor Zeb1 - ein zentraler Aktivator der epithelio-mesenchymalen Transition (EMT) - eine Metastasierungs-hemmende Subgruppe von TAMs definiert. Ziel des Projektes B01 ist zu verstehen, wie Zeb1 die Entstehung von TAM-Subgruppen reguliert, wie Zeb1+ TAMs die metastatische Kolonisierung in Modellsystemen hemmen und schließlich die Ergebnisse an humanen Krebserkrankungen zu validieren.
B02
Die Interaktion von Tumorzellen mit Zellen des Immunsystems hat einen Einfluss auf die Etablierung und Metastasierung von Tumoren. In Abhängigkeit vom Zytokinmillieu können Makrophagen und andere myeloide Zellen Entzündungen fördern oder aber eher zur Geweberegeneration beitragen und damit Immunreaktionen gegen Tumoren inhibieren. In der Tat konnte gezeigt werden, dass Tumor-assoziierte Makrophagen (TAM) in Abhängigkeit des Organs, in dem sich ein Tumor befindet, Tumorwachstum und Metastasierung sowohl unterstützen, als auch inhibieren können. Die Ziele des beantragten Projektes sind es, (1) herauszufinden welche TAM Untergruppen an einer Modulation des Tumorwachstums und der frühen Metastasierung beteiligt sind, (2) wie der Phänotyp dieser TAM Subpopulationen verändert werden kann und (3) wie das Wachstum und die Metastasierung von humanen Melanomen in einem humanisierten Mausmodell unterbunden werden kann.
B03
Analysen unterschiedlicher Tumor- und Entzündungsmodelle ermöglichten im Vorfeld die Identifikation einer speziellen Trem2+ Makrophagenpopulation. Diese Zellen scheinen über potente immun-regulatorische Eigenschaften zu verfügen und in der Lage zu sein, Tumor- und Entzündungsherde physisch abzukapseln um einer weiteren Zerstörung des umliegenden Gewebes vorzubeugen. Im Projekt B03 wollen wir die Rolle und Entwicklung dieser Makrophagenpopulation im Kontext der Organmetastasierung genauer untersuchen. Der Fokus soll hierbei auf moderne Bildgebungsverfahren, Einzelzell- und räumliche Sequenzierungsverfahren gelegt werden. Zusätzlich soll überprüft werden, ob diese Zellen einer therapeutischen Intervention zugänglich sind um Metastasen zu behandeln bzw. zu verhindern.
B04
Regulatorische T-Zellen (Treg-Zellen) spielen eine zentrale Rolle für die Initiierung einer prämetastatischen Nische und die Tumormetastasierung. Sie können durch eine neue Zellpopulation Aire+ tolerogener Antigen-präsentierender Zellen (BMACs) im Knochenmark induziert werden, die Selbstantigene präsentieren. Wir werden die Rolle von BMACs als Schlüsselregulatoren der Immuntoleranz gegenüber metastasierten Krebszellen und der frühen Tumormetastasierung untersuchen. Mithilfe neuer transgener Reportermäuse werden wir i) die Rolle von BMAC-induzierten Treg-Zellen bei der Tumormetastasierung und KM-Kolonisierung entschlüsseln, ii) bestimmen, inwieweit BMACs zum Treg-Repertoire beitragen, iii) Mechanismen der Treg-Zellinduktion durch BMACs identifizieren und iv) Mechanismen untersuchen, die der Aire-Expression in BMACs zugrunde liegen. Die Ergebnisse sollen Wege zur Hemmung metastasierungsfördernder Treg-Zellen eröffnen.
B05
Die Metastasierung beim malignen Melanom ist mit einer sehr schlechten Prognose für die Patienten verbunden. Dendritische Zellen (DCs) spielen eine wichtige Rolle bei der Induktion und Steuerung von angeborenen und adaptiven Immunantworten. Obwohl die Rolle der DCs bei soliden Primärtumoren bereits begonnen wurde zu untersuchen, ist ihre Funktion während der metastatischen Kolonisierung und des ungestörten Wachstums von Melanommetastasen in einem neuen Gewebemikromilieu weitgehend unbekannt. Im Projekt B05 wollen wir die Immunkontrolle der metastatischen Kolonisierung durch DCs verstehen. Wir werden verschiedene DC-Subtypen in Melanommetastasen charakterisieren, sie mit DCs aus Primärtumoren und entsprechenden Normalgeweben vergleichen, ihre spezifischen immunmodulatorischen Effekte auf T-Zell-Subpopulationen in in vitro- und in vivo-Modellen definieren und die entsprechenden DC-Subpopulationen für mögliche therapeutische Ansätze untersuchen.
B06
Es gibt überzeugende Beweise dafür, dass IL-33, ein Mitglied der IL-1-Familie und der entsprechende Rezeptor ST2 für das Fortschreiten von Tumoren und deren Metastasierung wichtig sind. Die zelluläre Quelle von IL-33 sowie die zellulären und molekularen Signalwege, die in ST2-positiven Immunzellen im Zusammenhang mit der frühen Metastasierung induziert werden, sind jedoch nicht verstanden. Sowohl regulatorische T-Zellen als auch Fibroblasten tragen nachweislich zur Metastasierung bei. Wir stellen die Hypothese auf, dass die IL-33/ST2-Achse durch die Interaktion von IL-33-produzierenden Fibroblasten und ST2-positiven geweberesidenten regulatorischen T-Zellen eine wichtige Rolle bei der frühen Metastasierung spielt. Ziel dieses Projekts ist es, die für die frühe Metastasierung wichtigen zellulären und molekularen Mechanismen der IL-33/ST2-Achse funktionell zu charakterisieren, um neue interventionelle therapeutische Strategien zu entwickeln.
B07
Die Umgebung bei der Metastasierung bestimmt über erfolgreiche Kolonisierung von disseminierten Tumorzellen. Bei Metastasen des duktalen Pankreaskarzinoms (PDAC) bilden tumor-assoziierte Fibroblasten (CAFs) eine sehr heterogene Mikroumgebung. Dies wird durch Aktivierung des EMT-induzierenden Transkriptionsfaktors ZEB1 in nur einem Teil der CAFs verdeutlicht. Wir vermuten, dass ZEB1 die Spezifizierung und Funktion von CAF Untergruppen steuert und den Krankheitsverlauf bestimmt. Wir werden CAF Subpopulationen identifizieren und analysieren, sowie die Rolle von ZEB1 bei der Kolonisierung bestimmen. Wir verwenden Transplantations- und genetische Maustumormodelle, scRNA Sequenzierung, ex vivo Organschnitt-Mikroskopie und humane PDAC Organoid/CAF Co-Kulturen. Wir hoffen mit Erkenntnissen über CAF Untergruppen neue Therapieansätze zu identifizieren, die protumorigene Eigenschaften der Mikroumgebung bei der Kolonisierung bekämpfen.
B08
Fernmetastasen sind die häufigste Todesursache beim kolorektalen Karzinom (KRK). Für die Metastasenbildung spielt die wechselseitige Interaktion von disseminierten Tumorzellen und Stromazellen, wie z.B. Blutgefäßendothelzellen eine wichtige Rolle. Kürzlich konnten wir in KRK-Patienten eine tumormikromilieu-abhängige Gefäßplastizität nachweisen, die durch die Freisetzung des angiokrinen Proteins SPARCL1, das anti-angiogene und anti-tumorigene Eigenschaften besitzt, aktiv zur Tumorsuppression beiträgt. Im beantragten Projekt B08 werden wir den Einfluss von SPARCL1 auf die Expansion von disseminierten Tumorzellen untersuchen und bestimmen, ob es der lokoregionären sowie Fernmetastasierung entgegenwirkt. Die Untersuchungen werden an neuen metastasierenden organoid-basierten KRK-Mausmodellen durchgeführt. Die langfristigen Ziele des Projekts sind es, SPARCL1 als möglichen diagnostischen Marker zur Prognose des KRK-Metastasierungsrisikos zu etablieren und die Mechanismen seiner anti-tumorigenen Wirkung zur Bereitstellung neuer Therapieziele aufzuklären.
B09
Die Ausbreitung des Melanoms auf die Lymphknoten des regionalen Beckens hat eine wichtige Aussagekraft für den weiteren Verlauf der Erkrankung. Da Lymphknoten häufig reseziert werden, bieten sie die einzigartige Möglichkeit menschliche disseminierte Melanomzellen (DCCs) vor und während der metastatischen Koloniebildung zu identifizieren und ihr Zusammenspiel mit lokalen Immunzellen zu untersuchen. Eine Transkriptomanalyse von DCCs deutete auf eine Aktivierung der extrazellulären Vesikel-Produktion (EVs) während der Koloniebildung hin, die mit einer Erschöpfung der CD8 T-Zellen einherging, was auf eine grundlegende Rolle der EVs bei der Kommunikation zwischen DCCs und ihrer Nische hindeutet. Unsere Hypothese ist, dass DCC-EVs die metastatische Koloniebildung antreiben, indem diese den Phänotyp und die Funktion der umgebenden Immunzellen modulieren und das Wachstum von DCCS unterstützen, die noch keine Kolonie gebildet haben. Ziel des Projekts ist es, die Rolle der molekularen Bestandteile der DCC-EVs und der beteiligten onkogenen Pfade zu identifizieren und mechanistisch zu analysieren.
B10
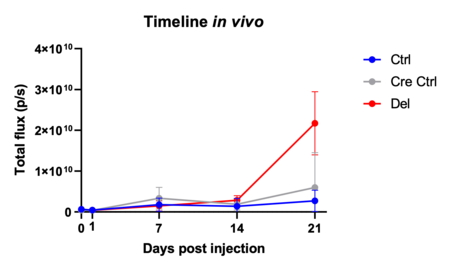
Epidemiologische Studien belegen eine Assoziation zwischen Adipositas und Tumorinzidenz bzw. –mortalität. In diesem Zusammenhang werden wir die Entstehung von Metastasen in normalgewichtigen und adipösen Organismen mittels nicht-invasiver Bildgebung erfassen. Im Projekt B10 sollen die molekularen Signalwege des Fettstoffwechsels in Knochen und Leber untersucht werden, welche bei der Kolonisierung durch Melanom und Mammakarzinom Zellen eine zentrale Rolle einnehmen. Im Fokus stehen dabei die Hypoxie, der IL-6 Signalweg und myeloide Zellen. Diese Ergebnisse werden schließlich in Patienten mit malignem Melanom und Mammakarzinom verifiziert, sodass die geplanten Experimente eine eindeutig translationale Ausrichtung haben, um eine frühere Detektion und neue therapeutische Ansätze von Metastasen zu erarbeiten.
B11
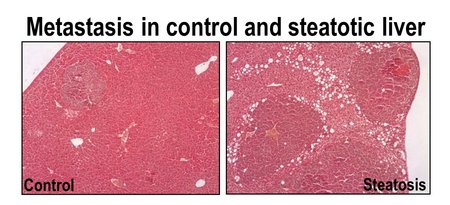
Die Leber ist sehr permissiv für die Metastasierung unterschiedlicher Tumoren und durch die Leberverfettung (Steatosis Hepatis) wird die Kolonisierung von disseminierten Tumorzellen weiter gesteigert. Ziel des Projektes ist es, die hierfür verantwortlichen molekularen Mechanismen zu identifizieren und das therapeutische Potential einer gezielten Inhibierung dieser Mechanismen zu validieren. Ferner wird untersucht, ob die identifizierten Faktoren auch die Kolonisierung von nicht-steatotischem Lebergewebe oder von anderen metastatischen Nischen beeinflussen.
B12
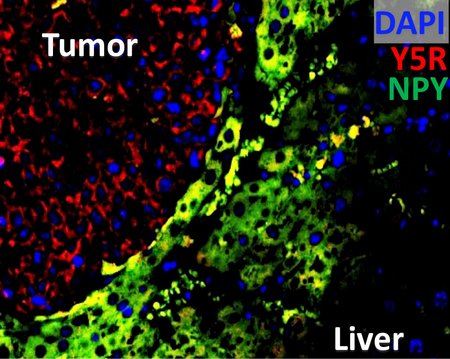
Entsprechend der "seed and soil"-Theorie liegt der Lebermetastasierung ein molekularer Cross-Talk zwischen Krebszellen und dem Leberparenchym zugrunde. Unveröffentlichte Daten zeigen starke chemotaktische Wirkungen des in der Leber und in sympathischen Nervenfasern produzierten Neuropeptid Y (Npy) auf disseminierte, Npy-Rezeptoren exprimierende Krebszellen. Diese Effekte könnten Tumorzell-"Homing", Nerveninfiltration und Leberkolonisierung begünstigen. In diesem Projekt soll der Npy-abhängige molekulare Cross-Talk zwischen der Leber-Nische und disseminierten Krebszellen unter Verwendung verschiedener in vitro- und in vivo-Modellsysteme sowie Patientengeweben charakterisiert werden. Zudem soll das Npy-abhängige Transkriptom in metastatischen Zellen und dessen Einfluss auf EMT-induzierte Gensignaturen untersucht werden und Npy-abhängige Signalwege hinsichtlich ihrer Rolle als therapeutische Ziele analysiert werden.
B13
Um die Mechanismen der frühen Metastasierung zu untersuchen und neue adjuvante Therapien in Anwesenheit autologer Immunzellen zu testen, werden bessere immun-kompetente DCC Modelle benötigt. Aus diesem Grund ist es ein Ziel von B13 neue Organoidmodelle aus DCC von Brust, Kolorektal- und Pankreaskarzinompatienten zu generieren. Um die Kolonisierung in einer komplexeren und repräsentativen Mikroumgebung zu untersuchen, etablieren wir zusätzlich Precision Cut Tissue Slices aus Lungen-, Leber- und Lymphknotengewebe und kokultivieren diese mit DCC und Immunzellen derselben Patienten. Um die Kultivierungsdauer der Gewebeschnitte zu verlängern werden zusätzlich neue mikrofluidische Systeme entwickelt. Ziel ist es repräsentative metastatische Nischen in vitro zu generieren, um Mechanismen der Kolonisierung in unterschiedlichen Organen zu erforschen sowie neue Therapieansätze zu testen, welche eine Metastasierung verhindern.
Z01
Das zentrale Projekt Z01 wird das Konsortium des TRR 305 bei der Erzeugung, Analyse und Handhabung großer Datensätze unterstützen, indem es Aufgaben wie Datenmanagement, Datenaustausch, Bioinformatik, Bildgebung und Bildauswertungen übernimmt. Daten werden mittels Web-Browser-Anwendungen allen Projekten des Konsortiums zugänglich gemacht, um einen effektiven Datenaustausch zwischen den Projekten ermöglichen. Zudem werden alle CRC-Projekte mit OMICS-Experimenten, der rechnergestützten Verwaltung und der statistischen Analyse von resultierenden Daten sowie mit der Visualisierung bzw. Interpretation der Ergebnisse unterstützt. Darüber werden aktuelle Mikroskopsysteme und Kleintierscanner spezifisch für die Bildgebung von Metastasen sowie High-End-Bildverarbeitungslösungen für die Mitglieder des TRR 305 angeboten, einschließlich automatisierter Bildanalyse-Technologien.
Z02
Der klinisch-pathologische Kern Z02 wird eine Plattform einrichten, die als einzigartige Ressource zum Testen, Validieren und Spezifizieren von Forschungsfragen dient, die in den verschiedenen Teilprojekten und dem TRR 305 im Allgemeinen behandelt werden. Zu diesem Zweck wird Z02 zwei verschiedene Ressourcen einrichten und bereitstellen: Erstens, eine Probenbank, die den Bedürfnissen der TRR 305-Projekte entspricht, und zweitens, Zugang und gezielte Nutzung der prospektiven molekularen Registerstudie PRAEGNANT. Die Probenbank wird eine klinische Infrastruktur für gezielte Post-Mortem-Autopsie-Studien, die Logistik für qualitativ hochwertige gezielte Post-Mortem-Probenahmeverfahren und eine Plattform zur prospektiven und longitudinalen Verfolgung von Krankheitsverläufen umfassen, um Fragen der zellulären und molekularen Krebsentwicklung zu behandeln. Darüber hinaus werden wir die Verfügbarkeit von Proben von Patientinnen mit metastasiertem Brustkrebs nutzen, die im Rahmen der prospektiven molekularen Registerstudie PRAEGNANT gesammelt wurden.